На рубеже ХХ – XXI вв. ряд технических достижений привел к скачку в понимании анатомии мозга. Первым было значительное улучшение разрешения микроскопов, что было связано с изобретением так называемого конфокального микроскопа (я покажу вам один из них в действии ближе к концу книги). Вторым стало развитие способов визуализации клеточных компонентов. Магические инструменты молекулярной биологии дали нам возможность создавать маркеры даже для самых крошечных частей субклеточного аппарата, а конфокальные микроскопы позволили наблюдать за его работой. Мы получили возможность видеть то, о чем раньше могли лишь мечтать: клетки в движении, плавающие в своей естественной среде; клеточные кластеры, где разные типы клеток светятся в темноте разными цветами, и т. д. Эти достижения позволили нам замахнуться на, как казалось ранее, немыслимое: составить полную опись
Проведенное Хайнцем Вессле исследование ганглионарных альфа– и бета-клеток, о котором я узнал на конференции во Флориде, показало нейробиологам, что мы можем подойти к изучению сетчатки с другой стороны: сначала составить полный список ее компонентов, а затем попытаться выяснить, какие функции они выполняют. Тем более что к тому времени у нас появились новые замечательные инструменты, которые позволяли это сделать.
Одним из таких инструментов была иммуноцитохимия (ИЦХ). Этот метод, получивший широкое распространение с начала 1990-х гг., позволяет обнаружить присутствие практически любой белковой молекулы внутри клетки или ткани. Если вы когда-нибудь смотрели видео с завораживающими светящимися нейронами, знайте, что их, скорее всего, снимали с использованием иммуноцитохимии. Это довольно простая техника, которая обеспечивает потрясающую визуализацию.
Конечно, не обходится без трудностей и разочарований. Как-то моя лаборатория потратила целый год впустую из-за некачественного коммерческого реактива (в финансовом плане этот неэтичный поставщик обошелся американским налогоплательщикам почти в $300 000). Как бы то ни было, нейробиологи с головой погрузились в ИЦХ-исследования: Харви Картен и Ник Бреча, пионеры этого метода; Джули Санделл сначала в Гарварде, затем в Бостонском университете; Берндт Эхингер в Швеции; Хайнц Вессле и Лео Пайхль в Германии; Дайана Редберн и Стив Мэсси в Техасе и, разумеется, я. Благодаря иммуноцитохимии молодой новозеландский исследователь Дэвид Вэйни нашел свое призвание: он прославился своими потрясающе красивыми снимками, сделанными через микроскоп, так что в конце концов ушел из науки и начал карьеру фотографа.
При наличии подходящих ИЦХ-реагентов этот метод позволял увидеть через флуоресцентный микроскоп все клетки сетчатки, содержавшие конкретную молекулу-мишень. При малом увеличении перед вашим взором представало поле светящихся звезд на темном фоне. При большом увеличении можно было детально рассмотреть форму отдельного нейрона, его тонкие отростки, извивающиеся по сетчатке или ныряющие в глубь нее, его структуру связей с другими клетками. Но как найти вещества-реагенты с избирательным воздействием на конкретные молекулы, которые присутствуют в интересующих нас подтипах нейронов сетчатки? Это делалось (и делается до сих пор) методом научного тыка. Лучшими реагентами были и остаются синаптические нейромедиаторы: дофамин, наш старый знакомый ацетилхолин, серотонин и т. п., каждый из которых присутствует в относительно небольшом наборе нейронов сетчатки. (Разумеется, нейроны содержат намного больше различных молекул, предположительно десятки тысяч. Но большинство из них – особенно те, что отвечают за поддержание клеточной структуры и обеспечение клетки энергией, – присутствуют во многих типах клеток не только в сетчатке, но и в головном мозге и других частях тела. Поэтому для нас такие молекулы бесполезны.)
Итак, опубликовав 20–30 научных работ, наша группа накопила достаточно данных, чтобы составить список из дюжины различных типов клеток сетчатки. Каждый из этих типов клеток окрашивался с высокой степенью надежности, что давало нам возможность четко увидеть всю популяцию клеток этого типа по всей сетчатке отдельно от других нейронов. Мы могли измерить их размер, изучить их форму и структуру связей и сосчитать – что, хотя и звучит банально, лежало в основе настоящей науки, которая уводила нас от коллекционирования бабочек в виде отдельных «типичных» клеток и вела к пониманию общей схемы и, как следствие, того, какую функцию выполняют разные типы клеток в зрительной системе. Например, некоторые типы нейронов были очень малочисленны, но протягивали свои дендриты на большие расстояния по сетчатке. Это говорило о том, что эта популяция не могла быть вовлечена в передачу изображения с высоким разрешением. Низкая плотность клеток означала слишком крупные пиксели: каждая клетка передавала информацию о слишком большой области видимого мира, поэтому изображение, получаемое мозгом, должно было выглядеть состоящим из огромных расплывчатых пятен. И наоборот, некоторые типы крошечных клеток присутствовали в сетчатке в огромных количествах, и им была свойственна высокая плотность. Мы сразу же предположили, что эти клетки образуют канал передачи изображения высокого разрешения от фоторецепторов в мозг, и последующие исследования подтвердили наш вывод.
Таким образом, мы и другие лаборатории увлеченно изучали под микроскопом красивые светящиеся картинки и постепенно начинали понимать, как устроена сетчатка, – пока не столкнулись с проблемой отсутствия реагентов для окраски. Нам удалось найти всего несколько маркерных молекул, способных окрашивать конкретные типы клеток, а все остальное, что мы пробовали, не работало. В комнате остался огромный невидимый слон: бо́льшая часть клеток, которые мы сумели идентифицировать, относилась к редким типам. Поскольку иммуноцитохимический метод позволял выделять сразу целые популяции, мы видели, что большинство этих типов клеток распределено по сетчатке с очень малой плотностью: существовали целые области, где маркерные молекулы не окрашивали ни единой клетки. Если сравнить сетчатку с детской картинкой-раскраской, нам удалось раскрасить всего 20 % ее поверхности, а остальные 80 % оставались белым или, точнее, темным пятном.
Мы были обескуражены. Наше стремление разобраться в устройстве системы зрительной сигнализации ганглионарных клеток, казалось, наткнулось на непреодолимое препятствие: если мы не можем идентифицировать большую часть элементов системы, как мы можем надеяться узнать, каким образом эта система производит свои операции, такие как повышение контрастности, избирательность в отношении направления и т. п.?
Я признаю, что нашим желанием составить полный каталог нейронов сетчатки отчасти двигало простое любопытство. Представьте, что вам подарили старинные часы без инструкции по эксплуатации. Вас заинтересовало их необычное устройство. С функцией маятника все более-менее понятно. Но что делает каждая из этих блестящих латунных шестеренок и прочих деталей? Зачем они нужны? Сама Природа, этот божественный часовщик, дразнила наше любопытство.
Проблема с исследованием сетчатки и остальной части центральной нервной системы была в том, что, будучи окрашены неспецифическими красителями, все нейроны выглядели одинаково. Доступные универсальные красители высвечивали только тела клеток, тогда как именно тонкие нейронные отростки – дендриты, принимающие входные сигналы, и аксоны, посылающие сигналы другим клеткам, – делают каждый тип нейрона особым. Именно по этой причине изучение типов нервных клеток в прошлом страдало от отсутствия системности: нам приходилось работать с отдельными экземплярами, которые удавалось окрасить, и в наших теориях было слишком много места для случайности и догадок.
Мы считали, что в изучении сетчатки мы можем добиться прогресса. В отличие от многих других областей мозга, нам была известна ее функция. У сетчатки есть четко определенное начало и конец; информационные потоки текут через нее в одном направлении; она пространственно компактна – расстояние от фоторецепторов до ганглионарных клеток составляет всего около трети миллиметра. На наш взгляд, было вполне достижимой целью создать карту
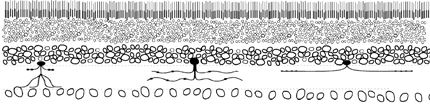
Но как подступиться к этой задаче? Перед нами лежала практически неизведанная территория. Даже об основных классах нейронов сетчатки – фоторецепторах, горизонтальных, биполярных, амакриновых и ганглионарных клетках – на тот момент имелись лишь обрывочные сведения. При использовании обычных красителей эти пять типов клеток выглядели почти одинаково, отличаясь друг от друга немногим больше, чем маленькие овалы на рисунке на следующей странице. Мы знали о существовании этих больших классов клеток и примерно догадывались об их количестве, но как получить более точную информацию обо всех элементах системы? Сетчатка выглядела для нас примерно так, как на этом рисунке: мы могли идентифицировать несколько отдельных клеток (здесь они нарисованы как черные кружки с отростками), а остальные (белые кружки) оставались для нас загадками.
За советом я обратился к Элио Равиоле, старшему сотруднику кафедры нейробиологии Гарвардского университета, магу нейроанатомии. Мой вопрос состоял в следующем: может ли электронная микроскопия (одно из многочисленных искусств, которыми он владел) помочь нам увидеть различия между нейронами? Конечно, ответил он, но это потребует невероятно кропотливого труда: кому-то придется сидеть за специальным резаком (микротомом), делать с образцов сетчатки десятки тысяч ультратонких срезов и затем исследовать их под микроскопом. Поскольку у Элио были дела поважнее, он направил меня к своей итальянской ученице Энрике Стреттои. Энрика оказалась талантливым молодым ученым, абсолютно бескомпромиссным в отношении науки. Вместе с Равиолой они провели потрясающее исследование нейронных связей в сетчатке с использованием электронной микроскопии серийных срезов. Энрика привнесла в нашу команду свои навыки, дисциплину и страсть, а также подсказала ключевую идею, благодаря которой мы сумели достичь нашей цели.
«Нам не нужно гробиться над анализом высокого разрешения, – сказала она. – Зачем возиться с тонкостями строения каждой клетки? Давайте просто идентифицировать клетки по их корневым дефинициям – по путям их отростков к синаптическим слоям сетчатки». В масштабе электронной микроскопии отростки нейронов выглядят огромными. Если на то пошло, заметила Энрика, их можно хорошо разглядеть даже через оптический микроскоп с максимальной разрешающей способностью. В этом случае потребуется гораздо меньше серийных срезов, потому что срезы для оптической микроскопии могут быть в десять раз толще, чем для электронной, и охватывать гораздо более обширные области. Таким образом, тестовые образцы сетчатки, по сути, представляли собой трехмерные сплошные объекты, чью внутреннюю структуру мы собирались изучить на основе двухмерных изображений их срезов (в наши дни цифровой визуализации это не представляло бы большого труда, но в те времена все было намного сложнее). Нашей целью было точно идентифицировать все до единой клетки в тестовых образцах.
Взяв подготовленные нами в Бостоне ткани сетчатки, Энрика вернулась в Пизу и принялась за работу. Она делала бесконечные серии срезов и фотографировала каждый срез под микроскопом. Негативы она отправляла нам в Бостон обычной международной почтой (благословенные технологии цифровой фотографии и электронной почты появились только после окончания этого проекта). Еще одним членом нашей команды была Ребекка Рокхилл, мой лаборант. Ребекка трудилась самоотверженно: когда я попросил ее отпечатать несколько тысяч фотографий, она молча закрылась в темной комнате на пять недель и в конце концов вышла из нее с толстенными пачками глянцевых фотографий размером 21,5 на 22 см, все еще источавших едкий запах фотореактивов.
Сидя за длинным столом, мы перебирали стопки снимков, скрупулезно отслеживая каждую клетку. Процесс происходил так: на фотографии № 1 вы видели множество клеточных тел нейронов – неправильной формы профили, срезанные в разных местах. Вы выбирали любую клетку, после чего брали фотографию № 2 и находили на ней ту же клетку, срезанную немного на другой глубине. Затем вы брали фотографию № 3, снова находили эту клетку и т. д., пока на очередной фотографии не обнаруживали выходящий из тела клетки отросток – аксон или дендрит. Теперь вам нужно было отследить, куда идет этот отросток – вверх к фоторецепторам или вниз к ганглионарным клеткам? Вы находили этот отросток на следующей фотографии и на следующей, прослеживая его траекторию до внутреннего или наружного синаптического слоя. Постепенно отросток становился все тоньше и тоньше и в конце концов исчезал. Разумеется, мы не могли проследить аксоны и дендриты до самых их окончаний, поскольку они становились слишком тонкими, чтобы их можно было зафиксировать на фотографии. Но мы могли проследить их достаточно далеко, чтобы с уверенностью сказать, идут ли они к внутреннему или наружному сетчатому слою.
Определение траекторий всех отростков клетки позволяло нам с высокой степенью надежности идентифицировать ее как биполярную, амакриновую или горизонтальную клетку. Мы опирались на корневые характеристики типов клеток: амакриновая клетка протягивает свои отростки только во внутренний синаптический слой сетчатки; горизонтальная клетка – только в наружный; биполярная клетка – в оба слоя.
Затем мы возвращались к первой фотографии и на теле клетки фломастером писали букву «Б» для биполяров, «А» для амакринов и «Г» для горизонтальных клеток. Если это была первая клетка того или иного типа, мы писали «Б1», «А1» или «Г1», после чего переходили к следующей.
Часть этой колоссальной работы проделал я сам, остальное сделали студенты, проходившие у меня летнюю практику. (Если вы думаете, что я испортил студентам лето и навсегда отбил у них вкус к нейробиологии, то это не так. По меньшей мере двое из них стали ведущими нейробиологами.) Поскольку каждой идентифицированной нами клетке присваивался свой инвентарный номер, который указывался на фотографиях, мы всегда могли вернуться и проверить свои выводы. Таким образом, мы вели предельно строгий учет: идентифицировали каждую клетку в образцах ткани из середины сетчатки и подсчитывали точную долю амакриновых, биполярных и горизонтальных клеток. Мы были абсолютно уверены в точности результатов.
Итак, закончив с этой работой, мы могли задать следующий вопрос: какое количество амакриновых клеток отсутствует в нашем реестре установленных клеточных типов? Мы начали с амакриновых клеток, потому что те были самыми большим классом нейронов внутреннего слоя сетчатки и наименее изученным. Другими словами: каково соотношение всех имеющихся в сетчатке амакриновых клеток и тех типов этих клеток, которые мы уже знаем? Ответ нас шокировал: известные нам типы амакриновых клеток в совокупности составляли всего 24 % от общего числа таких клеток.