Глава 3
Взламывая код
Я помню, как в первый раз вошла в настоящую исследовательскую лабораторию, помню звуки, запахи и ощущение открывающихся возможностей – чувства того, как постепенно раскрываются загадки природы. Это был 1982 год, и после первого курса колледжа я приехала к родителям на Гавайи. Мой отец, профессор английского языка в Гавайском университете, договорился со своим коллегой, профессором биологии Доном Хеммесом, о том, чтобы я смогла провести несколько недель в его лаборатории. Вместе с двумя другими студентами я получила возможность исследовать, как гриб
Атмосфера умиротворения и спокойной концентрации, характерная для маленькой исследовательской команды Дона Хеммеса, привлекла меня, однако с годами я осознала, что являюсь частью куда большего сообщества ученых и каждый из нас своим путем идет к открытию законов природы. Каждый крошечный шаг вперед был словно еще одной правильно подобранной деталью огромного пазла, в котором работа одного исследователя строится на работе других ради общей цели – сборки цельной картины.
Проект по изучению CRISPR хорошо символизирует этот аспект научной работы: несколько исследователей по всему миру работали над материалами, из которых в конце концов сложится огромная область исследования со всеми возможными последствиями и вариантами практического применения технологии. Когда мы собирали информацию о CRISPR, нашей маленькой командой двигали те же эмоции, что и множеством других ученых: чувство общности, совместной увлеченности и любопытства, – словом, те чувства, что и привлекли меня изначально в мир науки.
В те дни, когда эта область исследования только начинала развиваться, меня и Блейка заряжала энергией работа наших коллег из компании
Мы сконцентрировались на этих вопросах и, соответственно, на задачах, которые необходимо было решить, чтобы найти ответы. Нам нужно было выяснить, каким образом бактерии вытаскивают короткие фрагменты ДНК из генома фага в разгар инфекции и точнейшим образом встраивают их в существующую структуру CRISPR – так что у защитной системы появляется возможность нацеливаться на генетический материал вируса. Также нужно было определить, каким образом молекулы РНК CRISPR вырабатываются внутри клетки и превращаются из длинных нитей в гораздо более короткие, причем каждая из этих последних содержит отдельную последовательность, совпадающую с вирусной. И – что, вероятно, наиболее важно – нам предстояло выяснить, каким образом фрагмент РНК образует пару с комплементарным ему участком ДНК бактериофага и вызывает разрушение этой ДНК. Это было главным вопросом во всей системе защиты, которую мы изучали, и мы не могли полностью понять CRISPR, не объяснив эту сторону процесса.
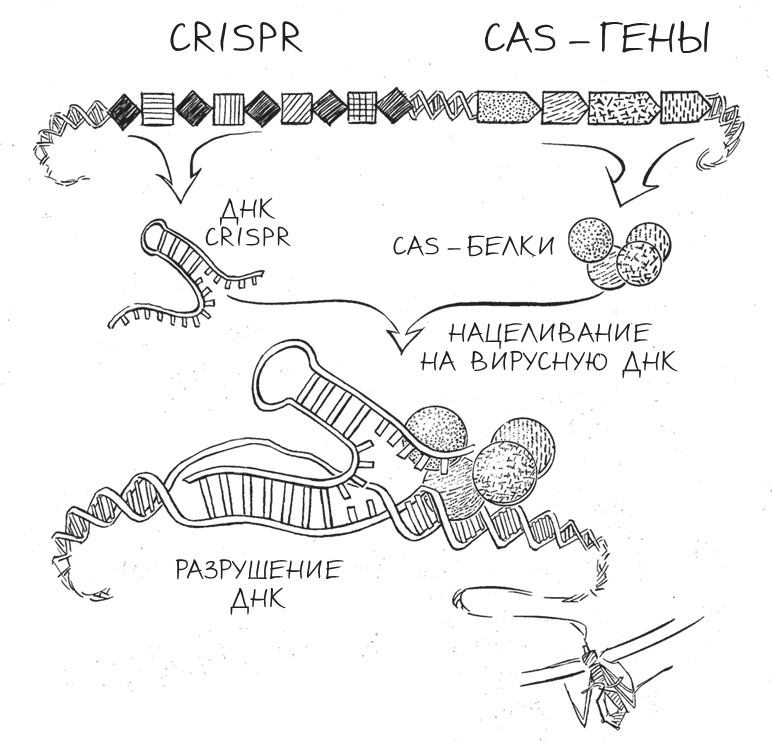
Было ясно, что для решения этих вопросов нам нужно выйти за рамки генетического исследования и применить скорее биохимический подход, который позволил бы нам изолировать молекулы, составляющие CRISPR, и изучать их поведение. Кроме того, было необходимо взглянуть на проблему в более широкой перспективе и рассматривать не только сам механизм CRISPR, но и все ассоциированные с CRISPR гены, или
Ученые могут многое узнать о функции гена, лишь посмотрев на его химический состав. Фрагменты ДНК, составляющие каждый ген, содержат всю информацию, необходимую клетке для сборки белков из аминокислот. Так как известен генетический код, который используют клетки для перевода четырех “букв” ДНК в двадцать “букв” белка, биологи могут определить последовательность аминокислот в белке, который будет производиться по информации с гена, зная только изначальную последовательность ДНК. Затем, сравнивая полученную последовательность аминокислот со сходными последовательностями у других, лучше изученных белков, ученые могут обоснованно прогнозировать функции многих различных генов.
Выдвигая такие многоступенчатые предположения, специалисты в области вычислительной биологии уже выяснили химический состав сотен различных
Мы предположили, что белки, кодируемые этими
Для начала Блейк выбрал два вида бактерий –
Блейк быстро сконструировал плазмиды из отдельных ассоциированных с CRISPR генов, скопировав последние из геномов
После отделения лишнего материала – разрушенных мембран, вязких ДНК и прочего клеточного “мусора” – у Блейка оставалось несколько тысяч бактериальных белков, из которых ему нужен был только один: Cas-белок. Но благодаря хитроумному строению плазмиды Cas-белок содержал особенный химический ярлык, или придаток, который отличал его от остальных тысяч белков. С помощью определенной стратегии очистки (а также проведя несколько раундов дополнительной очистки) Блейк смог отделить этот молекулярный придаток и получить чистые высококонцентрированные образцы каждого из Cas-белков, которые мы хотели изучать.
Когда Cas-белки оказались в его распоряжении, Блейк наконец смог проводить различные эксперименты для изучения того, что именно делают эти ферменты. Нашим первым вкладом в область изучения CRISPR была публикация о следующем открытии: мы обнаружили, что белковый фермент под названием Cas1 мог разрезать ДНК[67] таким образом, что это, возможно, помогало вставлять новые фрагменты ДНК фага в массив CRISPR на стадии формирования памяти иммунной системы. Это приблизило нас к пониманию того, каким образом CRISPR “ворует” кусочки ДНК у атакующих фагов и встраивает эту генетическую информацию в свою собственную, закладывая основу для двух фаз иммунного ответа: наведения на цель и ее уничтожения.
Приблизительно на этом этапе Блейк привлек к работе над проектом магистрантку Рэйчел Хорвитц, и вместе они сделали еще одно открытие. Работая со вторым белковым ферментом, Cas6, Рэйчел и Блейк обнаружили, что он, как и Cas1, функционирует в качестве своего рода химического колуна[68]. Однако в случае Cas6 задача заключалась в том, чтобы избирательно и методично разрезать длинные молекулы РНК CRISPR на более короткие куски, которые могли бы быть использованы для нацеливания на ДНК фага.
По мере того как мы и другие исследователи собирали детали CRISPR-пазла, медленно, но верно начинала вырисовываться общая картина. В ней мы уже могли различить ответы на некоторые вопросы, которые поставили перед собой в начале работы над проектом. Мы видели, что нам предстоит открыть еще множество функций Cas-белков. В ходе исследования мы обнаруживали все больше и больше таких белков, которые оказывались ферментами, разрезающими ДНК или РНК, – а значит, вероятно, играли в иммунном ответе CRISPR роль, похожую на роль Cas1 и Cas6.
К 2010 году проект по изучению CRISPR расширился, в него вошли еще несколько участников моей команды, включая соавтора этой книги Сэма Стернберга, и атмосфера в лаборатории буквально искрилась от радостного возбуждения. Наше понимание CRISPR, казалось, улучшалось каждую пару недель, а у изучаемых нами ферментов открывались интересные и необычные свойства, которые, как мы понимали, могут иметь практическое применение. К примеру, мы заинтересовались идеей использования новых ферментов, разрезающих РНК, в качестве своего рода диагностического инструмента для выявления отличительных молекул РНК вирусов человека, включая вирусы лихорадки Денге и желтой лихорадки; для воплощения этой идеи мы получили грант от фонда Билла и Мелинды Гейтс. Вскоре мы стали сотрудничать с биоинженерной лабораторией в Беркли, чтобы совместить эту технологию с их инновационной системой обработки крошечных количеств жидкости для выявления вирусов в крови или слюне.
Затем в 2011 году мы с Рэйчел основали компанию под названием