Почки относятся к классу органов, развивающихся из мезодермы. В процессе развития человеческого эмбриона формируются три пары почек, но на момент рождения остается только третья пара. Постоянные почки возникают ближе к хвостовой части туловища эмбриона. Сначала становится заметным плотное скопление, состоящее из нескольких сотен мезодермальных клеток. Почему оно возникает именно в этом месте и именно в это время, до сих пор непонятно, но скорее всего это происходит за счет того, что клетки мезодермы, во-первых, выделяют специфические для них белки, а во-вторых, начинают продуцировать HOX-белки, характерные для положения этих клеток на оси «голова – хвост» (глава 6). Исследователи уже выделили несколько ДНК-связывающих белков, необходимых для правильного формирования этого скопления клеток (так называемой метанефрогенной мезенхимы), но до полного понимания этого процесса еще далеко.
Первая важная функция метанефрогенной мезенхимы, которую я в дальнейшем буду называть просто мезенхимой, заключается в синтезе и секреции сигнального белка GDNF, распространяющегося по близлежащим тканям. Сразу после этого вольфов канал – одна из трубок, проходящих вдоль тела эмбриона, – дает ответвление непосредственно в мезенхиму (рис. 48).
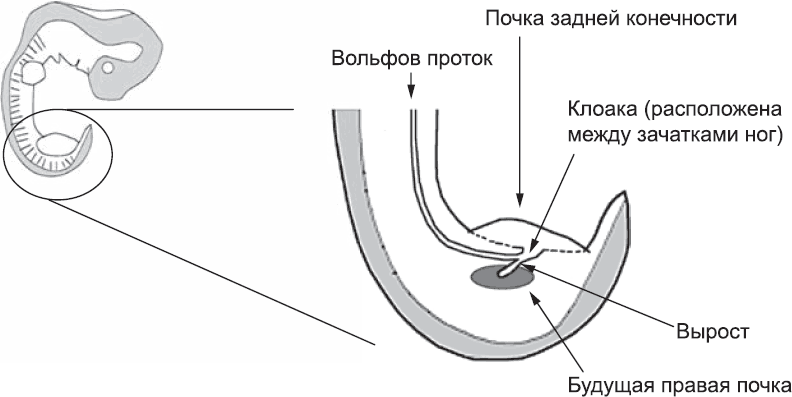
Рис. 48. Начальные этапы развития почки: заштрихованная группа клеток выделяет сигнальную молекулу (GDNF), а расположенный рядом вольфов проток посылает в направлении источника сигнала боковой отросток
То, что эти два события – начало производства сигнальной молекулы и образование выроста близлежащей ткани – происходят одно за другим, наводит на мысль о причинно-следственной связи между ними. Несколько разных экспериментов показали, что направленное врастание отростка в мезенхиму действительно связано с активностью GDNF. В экспериментах первой серии активность GDNF подавлялась (за счет блокировки химическими веществами[168],[169] или за счет мутации в кодирующем его гене мыши[170]); в отсутствие этого белка отросток формировался неправильно.[171] В другой серии экспериментов пропитанные GDNF пористые микросферы помещали рядом с вольфовым каналом, и тогда он, помимо обычного выроста в направлении мезенхимы, формировал дополнительные отростки в направлении микросфер. Таким образом, эксперименты первой серии показали, что сигнальная молекула нужна для конкретного процесса, а эксперименты второй серии – что этой молекулы в чистом виде достаточно для того, чтобы его запустить. За счет подобных разноплановых экспериментов исследователи и доказывают, что конкретный сигнал контролирует конкретный процесс, и рассуждения о сигнальных молекулах и реакции тканей, нередко встречающиеся в этой книге, базируются именно на них.
Процесс образования отростка вольфова протока похож на ветвление кровеносных сосудов в ответ на присутствие VEGF (глава 9) – молекулы разные (так и должно быть, чтобы не возникло путаницы), но принцип один. Если теперь извлечь этот орган, состоящий из окруженной мезенхимой трубочки, из эмбриона и поместить в чашку Петри, то он продолжит нормально развиваться.[172] Это означает, что с этого момента почки автономны и способны к самоорганизации. Для этого, однако, нужны и мезенхима, и зачаток мочеточника. Развиваться по отдельности они не будут, разве что экспериментатор пойдет на такие сложности, как «фальсификация» сигналов от отсутствующей ткани.
Итак, мезенхима посылает сигналы к отростку вольфова протока, но и он тоже посылает сигналы ей в ответ. Под их воздействием рыхлые клетки мезенхимы образуют плотный колпачок на конце трубки. Клетки, оказавшиеся в этом колпачке, начинают синтезировать новые белки и размножаться. При этом они по-прежнему выделяют GDNF и другие сигнальные молекулы, которые способствуют дальнейшему росту и ветвлению этого отростка и его ветвей. Когда трубки ветвятся, новые ветви тоже получают часть мезенхимы колпачка. В результате образуется ветвящаяся сеть трубок, и на конце каждой трубки есть колпачок GDNF-секретирующих клеток мезенхимы (рис. 49). Эти ветвящиеся трубки послужат основой для формирования мочевыводящей системы почки.
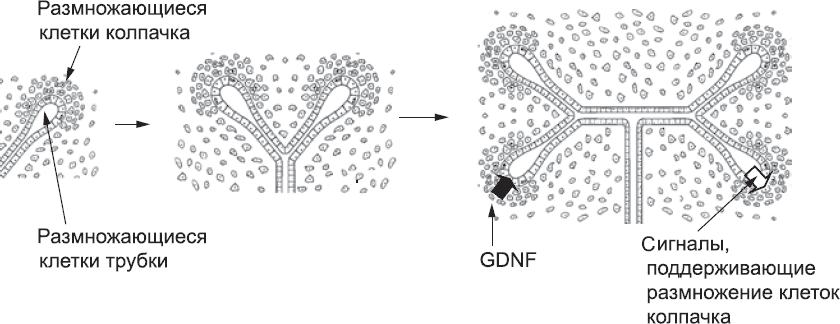
Рис. 49. Взаимозависимость клеток колпачка и клеток ветвящейся трубки. Клетки колпачка синтезируют GDNF, под действием которого клетки трубки размножаются, а трубка ветвится. Клетки трубки в свою очередь синтезируют факторы, которые поддерживают пролиферацию клеток колпачка. Совместное действие этих сигналов приводит к тому, что в процессе роста эти две популяции клеток находятся в равновесии
Яркой чертой этого процесса является взаимозависимость между размножением клеток ветвящихся трубок и колпачков. В принципе, можно представить себе альтернативную систему, в которой эти типы клеток размножаются сами по себе. Однако это чревато риском того, что клетки одного типа станут размножаться быстрее, чем клетки другого, и образуется либо множество незакупоренных трубок, либо множество колпачковых клеток, которым нечего закупоривать. Даже если представить себе, что скорость размножения разных клеток в нашем воображаемом органе абсолютно точно согласована, все равно есть риск, что растущие трубки удалятся от основной массы колпачковых клеток, что также приведет к развитию неправильно функционирующего органа. На практике зависимость роста трубок от сигналов клеток колпачка и зависимость клеток колпачка от сигналов трубок позволяет этим тканям «идти в ногу», то есть развиваться в едином ритме. Если клетки какого-то одного типа окажутся слишком далеко от популяции клеток другого типа, они просто перестанут размножаться, и никаких проблем не возникнет. Такая взаимозависимость между тканями – важная черта самоорганизации, характерная не только для почки, но и для других органов. Сигнальные молекулы могут быть разными, но общий принцип взаимозависимости остается тем же.
Контролируемого ветвления, о котором мы только что говорили, вполне достаточно для придания основных черт просто устроенному органу, например легким. Они состоят из сильно разветвленной системы дыхательных трубок, окруженных неплотно упакованными клетками и кровеносными сосудами. Однако зрелая почка имеет гораздо более сложное строение, так как, помимо разветвленного дренажного протока, в ней также есть нефроны. Когда развитие почки впервые попало в сферу внимания ученых, они предположили, что нефроны образуются как боковые ответвления дренажной системы. Однако в позднюю викторианскую эпоху (то есть к концу XIX в.) стало понятно, что на самом деле они формируются из мезодермальных колпачков. Это хороший пример того, что органы мезодермального происхождения имеют обыкновение создавать трубки с нуля, из подручных материалов. Чтобы понять, как это происходит, нужно сначала более подробно рассмотреть биологические особенности растущих трубок дренажной системы, потому что именно они контролируют развитие мезенхимы.
Пролиферация клеток ветвящейся трубки в основном приурочена к ее концу, где размножаются всего несколько десятков клеток.[173] При таком характере роста поддерживается некоторая популяция концевых клеток, а «отставшие» клетки формируют стенки основной части трубки. Они синтезируют немного другой набор белков, в частности сигнальную молекулу семейства WNT (WNT9b).[174] Клетки в нижней части колпачка получают больше всего WNT и начинают несколько иначе экспрессировать белки. Они покидают колпачок и создают небольшой плотный комок (рис. 50), которые впоследствии станет нефроном.
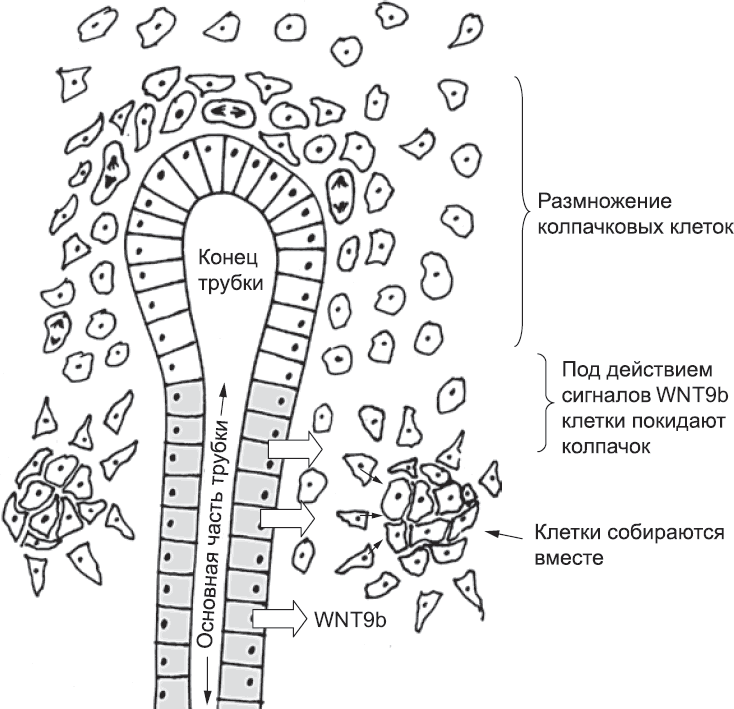
Рис. 50. Колпачковые клетки, отставшие от кончика трубки в результате ее роста, оказываются рядом с той частью трубки, где клетки секретируют белок WNT9b. Под действием этой и, возможно, некоторых других молекул мезенхимальные клетки группируются и готовятся сформировать нефрон
К тому времени, когда нефрон находится на стадии полого шара, разветвленная дренажная трубка, стволовая часть которой и запустила процесс его образования, продвинется далеко вперед. Ее конец снова разветвится и будет расти дальше, а стволовая часть новой ветви подаст сигнал WNT новой группе клеток колпачка. Образуется еще один нефрон. Таким образом, нефроны формируются один за другим по мере продвижения вперед дренажной системы.
Зависимость формирования нефронов от сигнала WNT, поступающего из стволовой части трубки, приводит к тому, что нефроны всегда образуются в непосредственной близости от дренажной трубы, с которой они в конечном итоге соединятся. Надежность соединения очень важна, и существующая система обеспечивает ее гораздо лучше, чем если бы клетки «принимали решения» независимо от ткани, к которой должны в конечном итоге присоединиться. Тем не менее близость к ветвящемуся зачатку мочеточника порождает и потенциальную проблему, потому что сложный и деликатный процесс формирования нефрона может нарушиться, если зачаток мочеточника направит отросток в этом направлении. Избежать этой проблемы позволяет следующий прием: клетки, приступившие к формированию нефрона, отключают синтез фактора ветвления GDNF и включают синтез других факторов, которые ингибируют образование новых ветвей. Этот ловкий трюк позволяет практически исключить риск того, что новые ветви вторгнутся в область формирования нефрона.
Переход от синтеза способствующего ветвлению белка GDNF к синтезу ингибирующего фактора имеет масштабные последствия. Клетки, к которым еще не приблизились отростки дренажной системы, будут по-прежнему синтезировать GDNF, а клетки в области, куда ветви уже проникли, перестанут это делать. Это означает, что новые отростки автоматически направятся туда, где отростков еще нет, а не туда, где отростки уже сформировались. Если по какой-либо случайности дренажная система пропустит какую-то область, ее клетки продолжат синтезировать GDNF (то есть «требовать» новый отросток) до тех пор, пока он там не появится. Поэтому система ответвлений автоматически распределится в пространстве таким образом, что будет эффективно обслуживать весь растущий орган. Равномерному распределению ее ветвей также может способствовать взаимное отталкивание ветвящихся концов. Есть веские основания полагать, что именно такая система действует при развитии млечных протоков в молочных железах[175],[176] (которые тоже ветвятся), и число аргументов в пользу существования аналогичной системы в почках постоянно растет.
Кровеносная система почек берет начало из почечной артерии и впадает в почечную вену, которые являются соответственно ответвлениями аорты и большой вены (глава 9). В почке сосуды должны образовать ветвящуюся систему, подводящую кровь к сотням и тысячам фильтрационных структур. Развитие кровеносной системы почек контролируется многими сигнальными молекулами, в том числе VEGF, о которой шла речь в главе 9.[177] Конец нефрона, в котором будет происходить фильтрация, выделяет VEGF и таким образом привлекает клетки кровеносных сосудов. Поэтому они растут в направлении будущих фильтрационных структур, обеспечивая их хорошее кровоснабжение. Надо полагать, что существует система, отключающая производство VEGF после того, как конец нефрона обеспечен кровеносными сосудами; в противном случае новые сосуды вместо того, чтобы расти в направлении новых нефронов, пытались бы обеспечить ближайший, который в этом уже не нуждается.
Таким образом, развитие почек, как и других внутренних органов, в значительной степени контролируется за счет «переговоров», которые разные клетки ведут между собой на языке распространяющихся сигнальных белков. Поведение конкретной клетки и особенно то, какие сигналы она подает, зависят от сигналов, которые она принимает. Такая система соткана из взаимосвязей. Это делает ее в высшей степени гибкой как с точки зрения коррекции ошибок при индивидуальном развитии, так и в плане приспособления к эволюционным изменениям. Например, если в результате эволюционных изменений период роста животного увеличится, то автоматически продлится и рост почки. Это произойдет просто за счет увеличения количества ответвлений собирающих протоков, нефронов и отростков кровеносных сосудов; никаких существенных изменений в систему вносить не придется. К глобальным изменениям размера и, в большой степени, формы тела органы могут приспособиться, используя внутренние «разговоры» между тканями. В системе, работающей на основе предварительно построенного «чертежа» (если допустить, что такое возможно), для простого двукратного увеличения размера органа пришлось бы вносить массу новых уточнений (на самом деле, если бы в «чертеже» было четко прописано местоположение каждого нефрона, число новых инструкций увеличилось бы вдвое). На практике же, судя по всему, для создания крошечной мышиной почки и большой почки человека используется одно и то же число генов.
Относительная независимость развивающихся органов, позволяющая даже выращивать их вне организма, имеет еще одно важное преимущество. В процессе эволюции позвоночных у них возникло несколько новых органов.[178] Например, поджелудочная железа впервые появилась у челюстных рыб, легкие с разветвленными дыхательными путями – у рептилий, а простата и молочные железы – только у млекопитающих. При развитии этих органов нередко используются системы контроля, которые эволюционировали для обслуживания развития уже существующих органов. Ветвление протоков предстательной железы регулируется с помощью сигнальных белков FGF, которые раньше использовались для контроля ветвления дыхательных путей легких, а еще раньше – для контроля ветвления протоков поджелудочной железы. Независимость и относительная изоляция систем контроля в пределах органов означают, что каждый орган может управлять своим развитием самостоятельно, не мешая другим органам. Следовательно, различные органы могут использовать ранее существовавшие системы контроля, что опять же уменьшает число новшеств, необходимых для эволюции новых структур.
Странная особенность развития почек – у крыс и, вероятно, у людей тоже – заключается в том, что оно очень чувствительно к алиментарному статусу матери. Если беременные крысы получали только половину нормального для них количества пищи, количество нефронов в почках их детенышей было значительно ниже нормы. Это, в свою очередь, приводило к повышению у них артериального давления.[179] (Цепь физиологических событий, обуславливающих это повышение, достаточно сложна – она основана на системе обратных связей с участием солей и гормонов ренина и ангиотензина, – но если попытаться представить ее в общих чертах, то можно сказать, что организм «пытается» прогнать нормальное количество жидкости через почки с малым числом нефронов за счет усиления напора.) Хронически высокое кровяное давление опасно для человека, так как оно повышает риск инсульта, инфаркта и, по иронии судьбы, болезней почек, снижающих и без того небольшое количество функциональных нефронов. Давно известно, что плохое питание матери может привести к тому, что у ребенка будет высокое давление, хронические нарушения работы почек и другие проблемы, например предрасположенность к диабет у.[180] Такое влияние условий развития плода на здоровье взрослого человека называется «пренатальным программированием», и, возможно, именно чувствительность развития почек к материнскому питанию лежит в основе этого явления.
С точки зрения жителя Западной Европы, привыкшего к полноценному питанию, пренатальное программирование может показаться абсолютно неадаптивным. Тем не менее не исключено, что понижение количества нефронов возникло как адаптация к периодам голода, позволяющая удержать в крови каждую драгоценную крупинку питательных веществ и солей. Это мнение подкрепляют два хорошо изученных случая массового недостаточного питания матерей во время Второй мировой войны. (Правда, в обоих случаях изучали не почечную недостаточность, а другую болезнь, связанную с пренатальным программированием, а именно сахарный диабет II типа.) В случае голландской «голодной зимы» 1944 г. острая нехватка продуктов питания, продолжавшаяся несколько месяцев, сменилась относительным изобилием после освобождения Нидерландов. У детей, рожденных от голодавших матерей, впоследствии наблюдался высокий уровень болезней, связанных с пренатальным программированием, прежде всего диабета II типа. Во время блокады Ленинграда голодавшие жители не получили такого внезапного облегчения, и дети питались скудно еще долгое время после рождения. Болезней, связанных с пренатальным программированием, среди них отмечено меньше. Такая интерпретация данных не бесспорна (определенную роль могли сыграть, например, генетические различия между популяциями), но, по крайней мере, некоторые ученые склонны делать вывод о том, что пренатальное программирование плода может играть положительную роль в условиях недостатка пищи. Опасность возникает только тогда, когда «настроенный» на голод ребенок вдруг начинает получать обильное питание.[181] Правильный ответ на вопрос, так ли это, имел бы большое практическое значение. Он позволил бы дать четкие клинические предписания о том, нужно ли кормить новорожденных с низкой массой тела молочными препаратами с высокой энергетической ценностью, чтобы стимулировать быстрое восстановление веса до нормального уровня.
Каждый конкретный орган тела имеет уникальное строение и специфические особенности развития. Тем не менее ключевой вывод из рассказа о развитии почки – то, что оно происходит за счет гибкой межклеточной коммуникации, а не строго запрограммированной последовательности событий, – в равной мере справедлив для всех органов.