
Рис. 32. Разметка областей сомита, которые будут дифференцироваться в разных направлениях, происходит за счет сигналов от соседних тканей
Однако сомит также чувствителен к сигналам, поступающим от нотохорда и вентральной пластинки нервной трубки. В участках сомита, расположенных ближе всего к этим источникам сигналов, концентрация соответствующих сигнальных белков достаточно высока. Они блокируют сигналы, стимулирующие образование мышц и кожи, и «сообщают» клеткам, что они должны образовать соединительную ткань и кости[113],[114] (рис. 32).
Итак, обобщая сказанное в этой главе, мы видим, что окружающие ткани подают сигналы, за счет которых происходит дифференциация нервной трубки, а клетки нервной трубки реагируют на эти сигналы, в том числе и тем, что подают сигналы, под действием которых происходит разметка окружающих тканей и они приступают к дифференцировке. Таким образом, тонкая детальная разметка строения эмбриона, который еще недавно имел довольно однородное строение, является результатом многочисленных «обменов репликами» на клеточном уровне.
Ткани, о которых шла речь в этой главе, не уникальны. Те же самые общие принципы можно было бы продемонстрировать на примере любой другой группы соседних тканей. Во всем эмбрионе смежные участки тканей используют друг друга как источник сигналов для выделения внутри себя областей, клетки которых будут подвергаться дифференцировке, характер которой зависит от их расстояния до источника сигнала. Непосредственным результатом этого процесса является образование новых границ между только что дифференцировавшимися типами клеток в пределах исходно гомогенного участка ткани. Если эти типы клеток секретируют разные сигнальные белки, тот же прием можно использовать еще раз для создания еще большего количества отличающихся друг от друга областей. Это высокоэффективный механизм пространственной дифференцировки, и неудивительно, что примерно пятая часть генов человека нужна для производства белков, вовлеченных тем или иным образом в процесс клеточной сигнализации.
Клеточная коммуникация не только позволяет тканям дифференцировать внутри себя практически неограниченное число областей. Она также служит отличным механизмом борьбы с ошибками в процессе развития. Представьте себе эмбрион, в котором дифференциация участков тканей не зависела бы от положения окружающих тканей, а происходила бы каким-то иным путем, например, клетки действительно следовали бы пошаговым инструкциям к какому-то чертежу. Малейшие неточности в положении конкретных клеток приводили бы к постепенному накоплению ошибок; когда пришло бы время тканям собираться вместе, типы клетки, которые должны были бы соседствовать, оказались бы в разных местах, и развитие остановилось бы. В принципе, таким образом можно построить очень маленький и простой организм – при малом числе типов тканей и жизненно важных связей между ними ошибки просто не успеют накопиться. Однако создать «по инструкциям» организм, состоящий из сотен разных типов клеток, которые должны тонко взаимодействовать друг с другом, нельзя. Напротив, если ткани в системе полагаются на сигналы друг друга, дифференциация клеток в каждой из них автоматически происходит на правильном расстоянии от ткани, сигналы которой управляют этим процессом, даже если, скажем, эта «управляющая» ткань находится немного не там, где надо. Таким образом, организация системы подстраивается к меняющимся обстоятельствам, и ошибки не накапливаются, а корректируются на каждом этапе. Поэтому эмбрион способен справиться практически со всеми ошибками, за исключением серьезных аномалий, – постоянное «общение» клеток позволяет регулировать развитие в соответствии с реальной ситуацией, а не с абстрактным планом.
Использование общения на языке белков для регуляции дифференцировки тканей имеет одно интересное следствие для развития животных. Расстояние, на которое может распространяться белок в рабочих концентрациях, ограничено биофизическими и биохимическими законами и составляет для большинства белков около одной двадцатой доли миллиметра (50 мкм). Это означает, что длина группы клеток, использующих этот метод для нанесения разметки, предшествующей клеточной дифференцировке, как правило, составляет примерно 1/20 мм. Это относится как к расстоянию между дорсальной и вентральной частями нервной трубки, так и, например, к расстоянию между развивающимися корнями зубов или волосками. Из этого следуют две вещи. Во-первых, невозможно нанести разметку на весь эмбрион сразу. Сначала, пока эмбрион еще достаточно мал, нужно нанести грубую разметку, а потом, когда уже намеченные части увеличатся в ходе роста эмбриона, можно приступать и к их детализации. Это одна из причин того, почему человеческое развитие не может идти по пути создания крошечного, но полноценного ребенка, который затем только увеличивался бы в размерах. Последовательные фазы детализации должны быть распределены по этапам роста. Сначала обособляются голова и туловище, потом, когда голова вырастает, намечается, например, челюсть, затем, когда увеличивается челюсть, намечается положение зубов и так далее.
Второе следствие заключается в том, что нанесение любой разметки, например выделение зон нервной трубки, может произойти только на определенном этапе развития, когда размер эмбриона находится в довольно строгих границах. В частности, это означает, что на этом этапе развития зародыши землеройки, человека и синего кита должны быть практически одного размера. Эволюционное сходство животных – скажем, лошадей, китов и летучих мышей, которые, будучи очень разными, относятся к одному и тому же классу, – гораздо отчетливее видно на эмбрионах, чем на взрослых особях.
Глава 8
Внутренние путешествия
Когда дорога вся в цветах, уже не спрашивают, куда она ведет.
Те клетки, которые сформируют лицо взрослого человека, располагаются в задней части головного отдела эмбриона. Те клетки, которые станут чувствительными нервами и пигментными клетками кожи, сначала находятся в районе позвоночника. А те клетки, которые стали вашими сперматозоидами или яйцеклетками, вообще какое-то время лежали за пределами вашего тела. Эти и многие другие подобные факты подчеркивают зависимость нашего развития от способности клеток раннего эмбриона перемещаться из одного места в другое. Миграции на клеточном уровне не менее удивительны, чем великие путешествия птиц и рыб, издавна восхищавшие зоологов, а возможно, и более, если учесть, что клетки, в отличие от птиц, перемещаются в постоянно меняющейся среде и делают это с исключительной точностью, хотя у них нет ни глаз, ни мозга, ни возможности учиться у родителей.
Чтобы понять, как это возможно, давайте разделим вопрос на две части. Сначала рассмотрим сам механизм движения клеток, а затем подумаем, за счет чего они двигаются в нужном направлении.
Способность клеток к движению возникла очень давно, за сотни миллионов лет до появления многоклеточных организмов. Основы механизма клеточной подвижности были заложены одновременно с возникновением первых эукариотических клеток (бактерий), ползавших по юной Земле в поисках пищи, и остались практически неизменными по сей день. Двигатель, который позволяет клеткам ползать, состоит из нескольких взаимосвязанных механизмов. Один выталкивает переднюю часть (лидирующий край) клетки вперед, другой обеспечивает образование новых контактов между клеткой и субстратом, по которому она движется, а третий использует эти контакты для подтягивания тела клетки, чтобы оно не отставало от движущегося вперед лидирующего края. На этих механизмах стоит остановиться более подробно, так как они представляют собой замечательный пример самоорганизации простых элементов в сложные системы более высокого уровня.
Механизм, выталкивающий вперед лидирующий край клетки, основан на работе тонкой сети белковых микрофиламентов, о которых уже шла речь в главе 5. Там мы говорили о том, что эта сеть позволяет поддерживать поле механических напряжений внутри эпителиальных пластов. Микрофиламенты в основном состоят из белка актина. Отдельные молекулы актина маленькие и компактные, но они могут связываться друг с другом и образовывать длинные тонкие нити (это и есть микрофиламенты) (глава 1). Новые молекулы актина легко присоединяются к свободным концам уже существующих цепочек, но лишь медленно и неохотно образуют цепочку «с нуля». Это означает, что новые микрофиламенты редко образуются в клетке без посторонней помощи, однако уже существующие микрофиламенты, как правило, быстро удлиняются. Формированию новых нитей способствуют белки, инициирующие полимеризацию актина. В клетке несколько типов таких белков, и они используются для разных целей. Те из белков, инициирующих полимеризацию актина, которые играют важную роль в движении клетки, обладают особым свойством: они работают только тогда, когда могут присоединиться к уже существующим актиновым нитям. Как следствие, новые нити образуются в основном как ответвления существующих нитей, а эти новые нити рано или поздно тоже образуют ответвления[115] (рис. 33).
Если бы белки, инициирующие полимеризацию актина, всегда были активны, клетка задохнулась бы в густой сети микрофиламентов. Этого не происходит, потому что эти белки, как правило, неактивны и должны активироваться другими молекулами. Некоторые из таких молекул крепятся к внутренней поверхности клеточной мембраны, поэтому белки, инициирующие полимеризацию актина, активируются только непосредственно под мембраной. Важно отметить, что они сохраняют активность лишь в течение короткого промежутка времени, а затем снова теряют ее. Это означает, что белки, инициирующие полимеризацию актина, активны в основном на внутренней поверхности клеточной мембраны и до дезактивации успевают продвинуться лишь на небольшое расстояние к центру клетки. Таким образом, новые актиновые нити образуются только в зоне, лежащей непосредственно под клеточной мембраной.
Актиновые филаменты, растущие в направлении клеточной мембраны, рано или поздно наталкиваются на нее. Именно за счет совместных усилий тысяч отдельных актиновых нитей передний край клетки и продвигается вперед.[116] Однако белки, инициирующие полимеризацию актина, не знают, где же, собственно, у клетки должен быть передний конец. Это, в конце концов, просто крупные молекулы, и в их структуре не зашифрована никакая карта. Многие из них инициируют образование ветвей, направленных в обратную сторону, то есть вглубь клетки. Дальнейшее удлинение таких бесполезных ответвлений было бы пустой тратой сил, но у клетки есть способы его предотвратить. Центральная часть клетки содержит много так называемых кэпирующих белков, которые «ставят заглушку» на конец нити и блокируют ее рост.
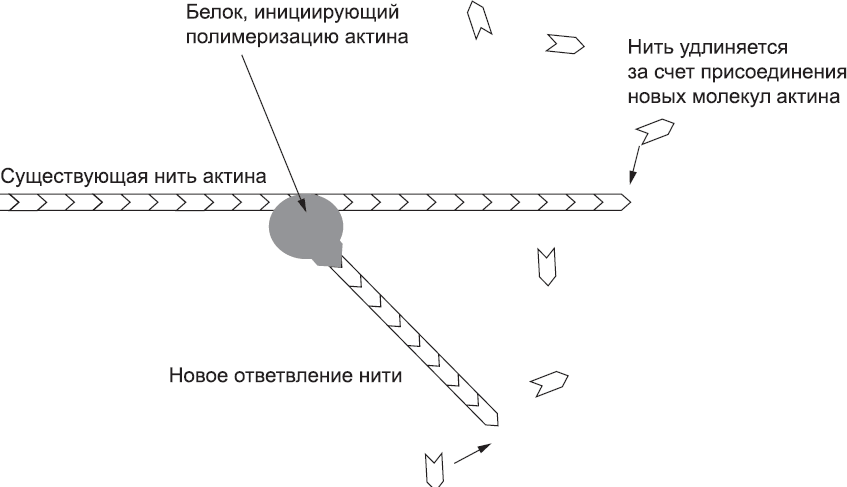
Рис. 33. Образование боковых ответвлений уже существующей актиновой нити за счет белковых комплексов, инициирующих полимеризацию актина
Если белки, инициирующие полимеризацию актина, обычно неактивны и активируются только после вовлечения прикрепленных к мембране молекул, то кэпирующие белки, наоборот, в норме активны и инактивируются молекулами мембраны. Поэтому нити, растущие по направлению к мембране, сталкиваются с кэпирующим белком в неактивном состоянии и могут свободно расти дальше, а нити, которые растут в неправильном направлении (вглубь клетки), быстро кэпируются. Таким образом, рост микрофиламентов в направлении мембраны основан на простой асимметрии среды клетки[117] (рис. 34).
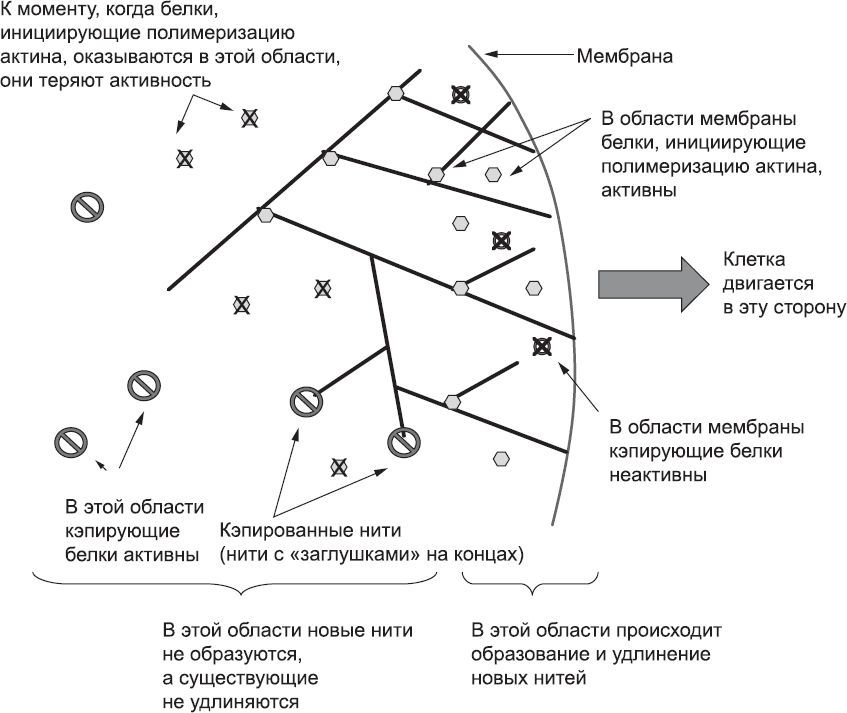
Рис. 34. Активация белков, инициирующих полимеризацию актина, и инактивация кэпирующих белков на мембране создают асимметрию среды, и в результате большинство новых микрофиламентов растет по направлению к мембране, а рост филаментов в других направлениях быстро блокируется
Согласованное действие белков на лидирующем крае клетки приводит к тому, что под давлением концов растущих актиновых нитей мембрана этого края проталкивается все дальше вперед. Согласно Третьему закону Ньютона («действию всегда есть равное и противоположно направленное противодействие»), если актиновые филаменты толкают мембрану вперед, то мембрана, в свою очередь, толкает филаменты назад. Если бы система микрофиламентов просто плавала в клетке, все попытки подтолкнуть мембрану вперед приводили бы к тому, что система «отплывала» бы назад. Чтобы этого не случилось, задний конец системы микрофиламентов должен быть закреплен на поверхности, по которой клетка двигается. Это достигается за счет комплексов адгезионных белков.[118]