Такая детерминация третьей популяции клеток нервного гребня поднимает один важный вопрос. В принципе популяция клеток нервного гребня может пойти по тому или иному пути двумя способами. По аналогии со старыми спорами о поведении человека можно сказать, что речь идет о выборе между «природой» и «воспитанием». Согласно теории «воспитания», ранее считавшейся справедливой, клетки изначально идентичны и приступают к дифференцировке в зависимости от окружения, в котором оказываются.[128] В случае «природной» обусловленности изначальные различия в характере экспрессии генов («природе») клеток сообщают им верное направление, чтобы они нашли место, соответствующее их предопределенной судьбе. Теперь мы знаем, что в случае клеточной дифференцировки «природа» важнее «воспитания» – достаточно посмотреть, как клетки вырабатывают различные наборы белков, которые заставляют их по-разному интерпретировать сигналы при выборе маршрута,[129] – хотя, как было отмечено выше, «пункт назначения» тоже играет важную роль, подавая сигнал прекратить миграцию и приступить к дифференцировке. Надо отметить, что признанная справедливой «природная» теория не помогает нам ответить на вопрос о том, как клетки нервного гребня выбирают свою дальнейшую судьбу, она просто говорит о том, что ответ надо искать на более раннем этапе, когда клетки еще не покинули нервную трубку.
Предыдущие страницы были посвящены исключительно клеткам нервного гребня туловищного отдела эмбриона. Клетки нервного гребня, начинающие свой путь из области шеи, головы и хвоста, имеют иную судьбу, а точнее, целый спектр возможных судеб. Они дают начало структурам, отвечающим за иннервацию кишки, костным элементам лица, пигментным клеткам радужной оболочки глаза, некоторым структурам уха и сердца. Эти клетки, как и те, о которых шла речь, следуют разными путями в зависимости от их будущей судьбы. Подробный рассказ о них был бы утомителен, поэтому ограничусь замечанием, что каждый из них столь же сложен, как и только что описанные пути. Это означает, что для правильной миграции клеток необходимо, чтобы они продуцировали много определенных веществ в нужное время. Генетические мутации, нарушающие нормальный синтез этих веществ (например, мутации, которые повреждают ген, кодирующий один из вовлеченных в процесс белков), вызывают врожденные дефекты развития. Эти дефекты известны под общим названием нейрокристопатии (заболевания, связанные с нервным гребнем). Например, некоторые мутации нарушают передачу сигналов, ведущих клетки нервного гребня из шейного и хвостового отдела в кишечник для создания там нервной системы.[130] У людей с этим дефектом частично или полностью отсутствует иннервация пищеварительной системы. Пища и непереваренные остатки плохо продвигаются по пищеварительному тракту, что приводит к очень тяжелым запорам – так называемой болезни Гиршпрунга. В большинстве случаев этой болезни требуется хирургическое вмешательство в раннем детстве. Другой набор мутаций – в генах, контролирующих внутреннее состояние и дифференцировку клеток нервного гребня, вызывает синдром Ваарденбурга.[131],[132],[133],[134] При этом расстройстве нарушения миграции или дифференциации клеток нервного гребня (особенно пигментных клеток) приводят к проблемам со слухом, с пигментацией радужной оболочки глаза и волос (часто встречается седая прядь на лбу) и в случае некоторых мутаций также к болезни Гиршпрунга. При образовании структур лица клеткам нервного гребня в области головы нужны определенные белки, такие как Treacle, чтобы активно размножающимся клеткам хватало строительных материалов. Мутации гена, кодирующего этот белок, приводят к нехватке основных строительных материалов, истощению и гибели многих клеток. Оставшихся клеток недостаточно для образования нормального лица, и рождается человек с синдромом Тричера—Коллинза[135] – с лицом необычной формы, раскосыми глазами, неразвитыми щеками, маленькой нижней челюстью, опущенными веками и недоразвитыми или отсутствующими мочками ушей.
Природа генов, мутации в которых приводят к нейрокристопатии, подчеркивает один важный момент, касающийся связи между развитием, генетикой и заболеваниями. В популярных статьях и даже в некоторых научных работах нередко встречается фраза «ген такой-то болезни». Если заболевание выражается в утрате или нарушении определенной структуры, например лица, это выражение создает впечатление, что нормальный (не несущий мутацию) ген отвечает за создание этой структуры. Однако, если рассмотреть белки, кодируемые генами, мутации в которых вызывают нейрокристопатию, станет ясно, что они являются частью сложнейших многокомпонентных механизмов, выполняющих такие задачи, как управление клеточными миграциями. Эти задачи решаются для другого структурного уровня и для другого пространственного масштаба (лицо по сравнению с ними – слишком сложная и крупная структура). Белок Treacle (как бы мы ни напрягали воображение) вовсе не формирует лицо. Он всего лишь играет некоторую роль в обеспечении эффективного синтеза рибосом – молекулярных «фабрик белка» (глава 1). Эта простая биохимическая задача не имеет прямого отношения к созданию лица. Однако при нарушении работы этого белка в клетках нервного гребня головы возникает резкая нехватка рибосом, что приводит к их стрессу и гибели.[136] Оставшихся клеток недостаточно для формирования нормального лица. Этот дефект и создает иллюзию того, что белок Treacle «отвечает» за формирование лица, в то время как на самом деле он только способствует образованию рибосом.
Общий вывод из примера с белком Treacle в равной мере справедлив и для подавляющего большинства других случаев: считать, что функция гена заключается в создании какой-то конкретной структуры тела, – это серьезное заблуждение. Если бы выдумки на генетическую тему ограничивались научной фантастикой, все было бы хорошо, но искаженное представление о том,
В качестве примера клеточных миграций я выбрал миграцию клеток нервного гребня, но это далеко не единственный тип мигрирующих клеток. На большие расстояния перемещаются клетки, дающие начало сперматозоидам и яйцеклеткам (глава 10), а также клетки, образующие кровеносную систему (глава 9). Огромное количество типов клеток мигрирует на короткие расстояния, организуясь в тесные группы, формирующие кости и части органов тела (глава 12). В ходе развития нервной системы небольшие группы клеток, мигрируя, создают длинные тонкие отростки (аксоны и дендриты), соединяющие нервные клетки друг с другом, а также с рецепторами и мышцами (глава 13). Защитные клетки иммунной системы способны мигрировать к очагам инфекции даже во взрослом организме (глава 17). Есть и печальные примеры: многие раковые клетки снова активируют механизмы миграции и распространяются из исходной опухоли в другие места, образуя метастазы. Существенная часть интенсивных исследований механизмов клеточного движения при нормальном развитии финансируется фондами изучения рака в надежде на то, что понимание нормальной миграции клеток поможет объяснить, как можно остановить опасный процесс метастазирования раковых клеток. Это лишь один из примеров того, как «чисто теоретические» эмбриологические исследования оказываются тесно связаны с решением насущных проблем, затрагивающих вопросы жизни и смерти конкретных людей.
Глава 9
Прокладка труб
Человек – ходячий шедевр водопроводных работ.
Клетки – объекты очень малого размера: как правило, около сотой доли миллиметра. Белки, которые участвуют во внутриклеточных реакциях, еще меньше: их радиус – примерно десятимиллионная доля миллиметра, а молекулы воды, в которой растворены белки, намного меньше их самих. На молекулярном уровне содержимое клетки находится в постоянном движении. Это не имеет никакого отношения к тому факту, что клетки живые. Движение, о котором я говорю, с тем же успехом продолжится и в мертвой клетке, впрочем, как и в теплом супе. Оно вытекает из основных законов физики. При любой температуре выше абсолютного нуля молекулы совершают случайные колебания и движения (температура – просто мера этой энергии движения, усредненная по популяции молекул). Движущиеся молекулы иногда сталкиваются, а затем отскакивают друг от друга. Если крупные молекулы, например белки, растворены в воде, молекулы воды сталкиваются и с ними, сообщая им часть своего импульса, поэтому молекулы белков тоже находятся в постоянном хаотичном движении.
Этот эффект можно наблюдать и на более крупных и тяжелых объектах, чем белки, например на пылинках. Римский поэт и ученый Лукреций еще в 60 г. до н. э. предположил, что хаотический «танец» частиц дыма в воздухе может быть связан с быстрым движением «атомов» (именно так он их назвал) – невидимые простым глазом, они случайно сталкиваются с частицами.[137] В жидкостях этот эффект впервые наблюдал Ян Ингенхауз в 1785 г., а 42 года спустя его вновь описал шотландский ботаник Роберт Броун. В его честь движение растворенных или взвешенных в жидкости частиц называют «броуновским» (что несколько несправедливо по отношению к Ингенхаузу), а открытие того, что это движение возникает из-за столкновения с невидимыми атомами или молекулами, обычно приписывают Эйнштейну (что несколько несправедливо по отношению к Лукрецию).
Броуновское движение имеет большое значение для развивающегося эмбриона, потому что хаотичное движение молекул является автоматическим механизмом транспортировки растворенных веществ (пищи, кислорода и «стройматериалов») туда, где они нужны. Ферменту, которому требуется конкретное вещество, остается только ждать, когда хаотическое движение приведет это вещество в контакт с ним. Этот механизм хорошо работает на небольших расстояниях, но, учитывая, что хаотично движущиеся молекулы часто меняют направление движения, при увеличении расстояния эффективность транспортировки падает. Для растущего эмбриона это очень существенно: поскольку пища и кислород поступают через стенки матки, клетки, находящиеся глубоко внутри развивающегося организма, рискуют остаться без необходимых веществ и погибнуть голодной смертью. Максимальное расстояние, на котором обычная клетка млекопитающего в плотной ткани может получать питательные вещества за счет случайной тепловой диффузии, в несколько десятков раз превышает диаметр клетки (некоторые специализированные клетки, в частности клетки скелета и связанных с ним тканей, могут находиться дальше от источника питательных веществ). Эмбриону бо́льшего размера – а центр туловища взрослого человека лежит на расстоянии примерно в тридцать тысяч клеточных диаметров от кожи – необходимо разработать систему эффективного транспорта питательных вещества в глубоко лежащие ткани. Такая система должна подводить питательные вещества достаточно близко к каждой клетке, чтобы они могли преодолеть оставшееся расстояние за счет хаотической тепловой диффузии. В организме человека и других позвоночных проблема решается за счет циркуляции жидкости-носителя – крови – по тончайшим трубочкам, расходящимся по всем уголкам тела.
Для работы кровеносной системы нужны четыре основных компонента: жидкая составляющая крови, переносящая основную часть питательных веществ и токсинов; свободно плавающие в ней клетки крови, отвечающие за перенос кислорода (транспортировать кислород в растворенном виде проблематично); замкнутая система труб для подведения крови к тканям; и насос для поддержания циркуляции крови между тканями, в которых кровь обогащается полезными веществами, и тканями, которые расходуют их. Все ткани развивающегося эмбриона потребляют питательные вещества и выделяют продукты обмена. В плаценте кровь эмбриона подходит очень близко к крови матери, которая обновляется и очищается с помощью легких, кишечника, печени и почек. Так как молекулы могут довольно свободно циркулировать между кровеносными системами матери и эмбриона, их концентрация, как правило, стремится к равновесию, поэтому в плаценте истощенная кровь эмбриона обогащается кислородом и питательными веществами и избавляется от отходов. Поэтому кровь эмбриона должна циркулировать по кругу от плаценты к телу эмбриона и обратно. Для этого должна появиться система кровеносных сосудов и «насос».
Сосудистая система эмбриона человека возникает в виде двух основных частей. Одна из них находится за пределами эмбриона, в желточном мешке, а другая – внутри эмбриона. Обе части важны и вместе формируют единую систему, но, чтобы немного упростить тему, в этой главе мы сосредоточимся главным образом на той части кровеносной системы, которая располагается в организме эмбриона.
Клетки, которые дадут начало первым кровеносным сосудам эмбриона, можно впервые различить в мезодерме[138] на самом краю тела эмбриона примерно в то время, когда формируется нервная трубка[139] (глава 5; рис. 38). Их формирование и размножение запускается сигнальным белком, VEGF, который секретируется другими областями мезодермы, а также эндодермой.[140],[141] В ответ на сигналы эти клетки – гемангиобласты[142] – начинают размножаться и производить белки, характерные для кровеносных сосудов. Это мигрирующие клетки; они чувствительны к сигнальным белкам, которые синтезируются сомитами, и мигрируют в направлении источника этих белков. Итак, гемангиобласты перемещаются от края эмбриона к средней линии его тела[143],[144] (рис. 38,
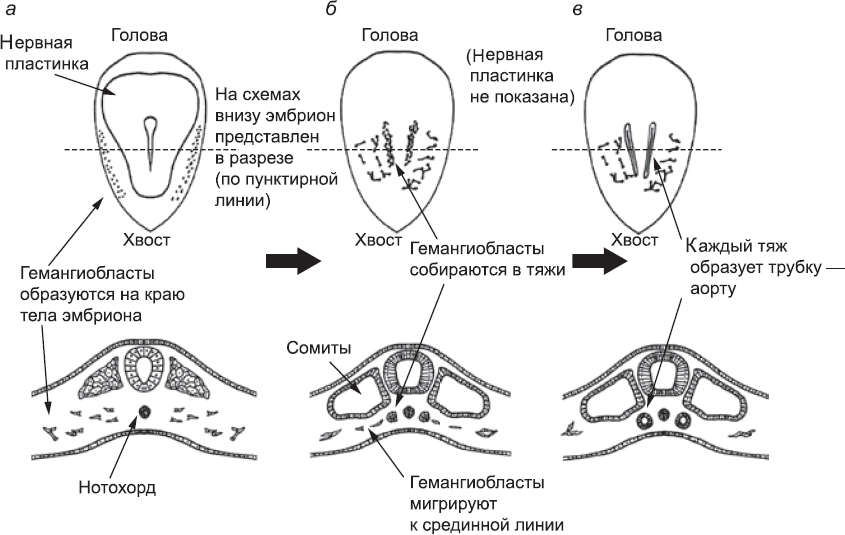
Рис. 38. Закладка аорт – первых артерий эмбриона: (
Если бы сигналов больше не поступало, развитие гемангиобластов остановилось бы. Продолжение развития, как и многие другие события в районе средней линии раннего эмбриона, зависит от сигналов белка Sonic Hedgehog, который вырабатывается нотохордом.[145] В присутствии этого белка гемангиобласты «прилипают» друг к другу, образуя сеть связанных клеток. Клетки, которые сошлись под сомитами, формируют такую плотную сеть, что с обеих сторон эмбриона она принимает вид плотных тяжей, проходящих под сомитами (см. рис. 38,
Важность поступления белка Sonic Hedgehog из эндодермы была показана в экспериментах двух типов, выполненных одной и той же исследовательской группой.[146] В первом эксперименте удаляли эндодерму, ликвидируя таким образом основной источник этой молекулы, и аорта не формировалась. Во втором эксперименте чистый белок Sonic Hedgehog добавили искусственным путем в эмбрион, лишенный эндодермы, и образование кровеносных сосудов налаживалось. Роль белка Sonic Hedgehog подтверждается тем фактом, что даже в простых чашках Петри можно заставить гемангиобласты создавать цепь сосудистых трубок, просто добавив этот белок.
Учитывая, что под влиянием сигнальных белков гемангиобласты слипаются друг с другом, есть риск того, что они образуют только один тяж, идущий вдоль средней линии тела. Чтобы этого не произошло, в действие вступают сигнальные белки малого радиуса действия, такие как Noggin. Их источником является нотохорд. Поскольку пространство под нотохордом (между ним и эндодермой) ограничено, эти белки эффективно блокируют формирование кровеносных сосудов вдоль средней линии. В результате образуются две отдельные аорты – по одной на каждой стороне тела[147] (рис. 40). Такое расположение сосудов нормально для раннего эмбриона, но в дальнейшем меняется по мере созревания плода.[148]
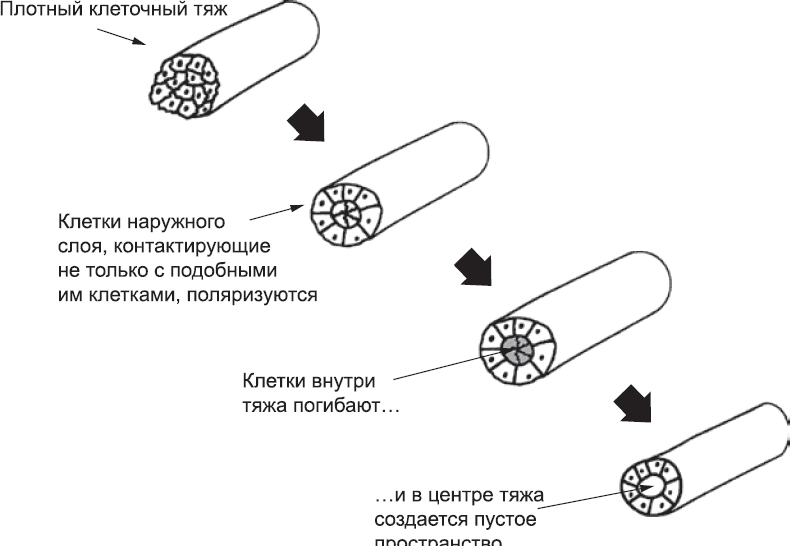
Рис. 39. Предполагаемая схема того, как плотный тяж гемангиобластов превращается в полый сосуд. (Происходит ли это именно так у человека, непонятно, но для других животных эта схема справедлива.) Внешний клеточный слой (его клетки асимметричны, так как контактируют не только с другими гемангиобластами) поляризуется, образуя герметичную трубку. Внутренние клетки, со всех сторон окруженные себе подобными клетками и лишенные контакта с тканью снаружи, погибают, и образуется полость, по которой в один прекрасный день потечет кровь
Кровеносные сосуды тела бывают двух типов – артерии и вены. Артерии – это сосуды с относительно маленьким просветом и толстыми стенками, по которым кровь идет под высоким давлением из сердца к мелким кровеносным сосудам в тканях. Вены – это сосуды большего диаметра и с более тонкими стенками, по которым кровь возвращается к сердцу под более низким давлением. Выяснилось, что судьба гемангиобластов предопределена еще до начала их миграции к средней линии тела. В клетках, которые дадут начало артериям, экспрессируется немного другой набор белков, чем в клетках, которые дадут начало венам (особенно это относится к белкам, которые принимают участие в межклеточных взаимодействиях). По крайней мере, у рыб, которые хорошо изучены в этом отношении, дифференцировка гемангиобластов на венозные и артериальные контролируется, опять же, белками семейства Hedgehog. Если клетка получает эти сигнальные белки в высоких концентрациях, она рано развивается, рано начинает миграцию и берет на себя функции артериального гемангиобласта. Если же клетка получает эти белки в низких концентрациях, то она развивается и мигрирует позже, становясь венозным гемангиобластом.[149] Разные наборы белков, выделяемые клетками с разной судьбой, позволяют им распознавать себе подобных и держаться вместе с ними. Клетки, запрограммированные на формирование вен, мигрируют по несколько иным маршрутам, но образуют кровеносные сосуды по той же основной схеме. Две крупные вены образуются параллельно аортам по всей длине эмбриона, но дальше от срединной линии (что вполне естественно, потому что концентрация белков семейства Hedgehog там ниже, и среда более благоприятна для образования вен).