Уотсон рассказывал о том, как научное сотрудничество с Фрэнсисом Криком позволило им обоим – используя критически важную информацию, собранную их коллегой Розалинд Франклин, – расшифровать эту простую и красивую молекулярную структуру. Именно тогда я ощутила первую искру интереса, который в конце концов и заставил меня выбрать похожий путь в жизни. (Много лет спустя я смогла резко ускорить собственную научную карьеру, расшифровав некоторые из первых трехмерных структур РНК – куда более сложных!)
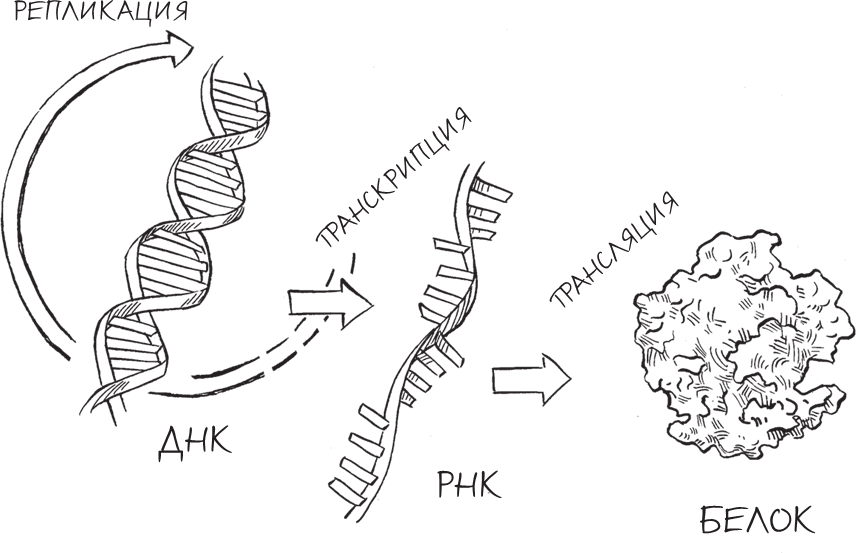
В годы, которые последовали за открытием Уотсона и Крика, другие ученые пытались понять, каким образом структура этой молекулы и ее достаточно простые химические составляющие могут кодировать информацию и объяснять многочисленные биологические явления. ДНК похожа на какой-то тайный, зашифрованный язык: каждая последовательность “букв” предоставляет собой инструкцию для образования определенного белка внутри клетки. Затем эти белки выполняют большинство жизненно важных функций в организме, например расщепляют пищу, распознают и уничтожают болезнетворные микроорганизмы, чувствуют свет.
Чтобы превратить инструкции, содержащиеся в ДНК, в белки, клетки используют важнейшую (и близкородственную ДНК) молекулу рибонуклеиновой кислоты (РНК), которая образуется по шаблону ДНК в ходе процесса, который называется транскрипцией. Три “буквы” в РНК совпадают с “буквами” ДНК, однако “буква” Т (тимин) заменена на У (урацил). Кроме того, сахар, образующий остов РНК, содержит на один атом кислорода больше, чем атом сахара в ДНК (потому-то последнюю и называют
Размер генома и число генов, содержащихся в нем, сильно различаются у представителей различных царств живого мира. У большинства вирусов, например, всего несколько тысяч “букв” ДНК (или РНК, так как в некоторых вирусных геномах нет ДНК) и небольшое количество генов. Геномы бактерий, с другой стороны, содержат миллионы “букв” и около 4000 генов. В геноме мух около 14 000 генов, распределенных среди сотен миллионов пар оснований ДНК. В человеческом геноме около 3,2 миллиарда “букв” ДНК и около 21 000 генов, кодирующих белки. Любопытно, что размер генома не всегда соответствует сложности организма; геном человека приблизительно такой же длины, как геном мыши или лягушки, где-то в десять раз короче, чем геном саламандры, и более чем в сто раз меньше, чем геномы некоторых растений.
Геномы различных видов живых существ могут иметь совершенно различную структуру. В то время как большинство бактериальных геномов существуют внутри клетки в виде одной непрерывной последовательности ДНК, человеческий геном состоит из 23 отдельных частей, которые называются хромосомами и имеют длину от 50 до 250 миллионов “букв”. Как и клетки большинства млекопитающих, клетки человека обычно содержат две копии каждой хромосомы, одну от отца, другую от матери. Каждый родитель передает ребенку 23 хромосомы, так что всего их получается 46. (Существуют исключения из этого правила; например, у людей с синдромом Дауна есть третья копия 21-й хромосомы.) Полный набор ядерных хромосом может быть найден практически в любой клетке тела (важное исключение – красные кровяные тельца, так как у них нет ядра[17]), однако ДНК хранится не только в ядре. В геном человека также входит отдельная мини-хромосома – она содержит всего 16 000 “букв” ДНК и расположена в митохондриях, “батарейках” клетки, производящих энергию. В отличие от генетического кода других хромосом, митохондриальная ДНК наследуется исключительно по материнской линии[18].
Мутации в любой из 23 пар хромосом или в митохондриальной хромосоме могут вызывать наследственные заболевания. Простейшая мутация называется точечной заменой – в этом случае один нуклеотид заменен на другой, и в результате соответствующий ген будет кодировать дефектный белок. К примеру, серповидноклеточная анемия, наследственное заболевание крови, случается при замене семнадцатой “буквы” гена под названием бета-глобин (с А на Т). При переходе от нуклеотидов к аминокислотам, то есть в ходе трансляции, эта мутация приводит к тому, что глутамат заменяется на валин, причем происходит это в критической области белка гемоглобина – компонента эритроцитов (красных кровяных телец), транспортирующего кислород. Последствия этого крошечного изменения в белке – меняются лишь десять атомов из более чем восьми тысяч – очень серьезны. Мутировавшие молекулы гемоглобина слипаются и образуют аномальные волокна, меняющие форму эритроцитов, что ведет к анемии, повышенному риску инсульта и инфекций, а также к сильной боли в костях.
Серповидноклеточная анемия – пример генетического заболевания, наследуемого по рецессивному типу. Это означает, что болезнь возникает тогда, когда обе копии гена
Другие генетические заболевания наследуются по доминантному типу, что означает, что всего одной мутантной копии гена достаточно, чтобы вызвать болезнь. Один из примеров этого – синдром WHIM, при котором тысячная “буква” гена
И серповидноклеточная анемия, и синдром WHIM – примеры генетических заболеваний, вызываемых простыми точечными заменами (ошибочной подменой одной “буквы” ДНК на другую). Однако генетические заболевания могут быть и результатом вставки (инсерции) или утраты (делеции) фрагментов ДНК. К примеру, нейродегенеративное расстройство, известное как хорея Гентингтона, происходит из-за мутации в гене
О генетических причинах многих болезней стало известно благодаря относительно недавнему изобретению секвенирования ДНК – процесса, который позволяет ученым прочитывать и записывать содержимое генома человека “буква за буквой”. После того как в 1970-х годах появились первые методы секвенирования, ученые начали кропотливо искать и идентифицировать генетические причины наиболее известных на тот момент наследственных заболеваний. “Квантовый скачок” в этой области произошел, когда был осуществлен проект “Геном человека”, начавшийся в 1990-х годах, когда ученые со всего мира объединились, чтобы отсеквенировать весь геном человека. При выполнении этой амбициозной задачи была использована новая технология, которая позволяла клонировать большие фрагменты ДНК человека в дрожжах. Реализации проекта также способствовали значительный прогресс в автоматизации лабораторных процессов и разработка сложных вычислительных алгоритмов для облегчения анализа данных, полученных при секвенировании. Проект стоил огромных усилий и средств (около 3 миллиардов долларов), и в 2001 году был опубликован первый “черновой вариант” генома.
С момента завершения проекта “Геном человека” процесс секвенирования ДНК и секвенирования целых геномов стал удивительно быстрым, дешевым и эффективным. Ученые точно идентифицировали более четырех тысяч различных мутаций, способных вызывать генетические заболевания. Секвенирование ДНК помогает выявить повышенный риск развития некоторых видов рака, подбирать индивидуальные методики лечения для пациентов с различной наследственностью. Сегодня коммерческий анализ ДНК стал общедоступным: он стоит лишь несколько сотен долларов за каждый тест, и миллионы людей решили сделать анализ собственных геномов, для чего им нужно было лишь предоставить образец слюны. Последовало значительное увеличение объема данных о человеческом геноме, что помогло исследователям выявить важные связи между тысячами вариантов генов и рядом физических и поведенческих черт.
И все же, несмотря на то что секвенирование генома отражает огромный прогресс в изучении наследственных недугов, это в конечном счете лишь диагностический инструмент, но не средство для их лечения. Оно помогло нам увидеть, как наследственные заболевания записываются на языке ДНК, однако секвенирование не дает нам никаких возможностей для изменения этого языка. В конце концов, научиться читать – далеко не то же самое, что научиться писать. Для этого ученым нужен совершенно другой набор инструментов.
Исследователи мечтали о связанных с ДНК методах лечения с тех пор, как было открыто существование генетических заболеваний. Когда некоторые ученые только начинали определять основополагающие причины наследственных заболеваний, другие уже находились в напряженном поиске новых методов лечения этих недугов – методов, которые позволили бы не только давать пациентам препараты, временно смягчающие нежелательные эффекты генной мутации, но и исправлять сам мутировавший ген, чтобы навсегда остановить болезнь. Приведу пример: серповидноклеточная анемия лечится сегодня при помощи частых переливаний крови, использования препарата гидроксикарбамида и пересадки костного мозга. Разве не лучше было бы атаковать саму мутацию ДНК, вызвавшую заболевание?
Пионеры исследований в этой области знали, что лучшим решением для лечения наследственных заболеваний было бы исправление дефектного гена – то есть целенаправленно проделать то же самое, что природа сделала случайно, исцелив Ким и других везучих пациентов вроде нее. Однако идея лечения наследственных недугов посредством переписывания мутантного генетического кода казалась фантастической – нечто поиска иголки в стоге сена, а потом вытаскивания ее из этого стога, причем нельзя было задеть при этом ни одной соломинки. Но вместе с тем ученые подозревали, что похожих изменений можно было бы добиться, добавляя целые замещающие гены в поврежденные клетки. Вопрос состоял в том, каким образом доставить этот ценный груз в нездоровый геном.
Зная о том, что вирусы обладают необычной способностью “вклеивать” новую генетическую информацию в ДНК бактериальных клеток, пионеры исследований генной терапии поняли, что вирусы можно использовать для доставки “лечебных генов” людям. Первые опыты подобного рода были проведены в конце 1960-х годов американским врачом Стэнфилдом Роджерсом – он изучал папилломавирус Шоупа, вызывающий вырастания на коже у кроликов. Роджерса особенно заинтересовала одна особенность этого вируса: в телах зараженных кроликов вырабатывалось слишком много аргиназы – фермента, нейтрализующего вредную аминокислоту аргинин[19]. В организмах больных кроликов было гораздо больше аргиназы и меньше аргинина, чем у здоровых животных. Кроме того, Роджерс обнаружил, что у исследователей, работавших с вирусом, уровень аргинина в крови также был ниже нормы. Видимо, эти ученые подхватили вирус от кроликов, и эта инфекция вызвала долгосрочные изменения также и в их телах.
Роджерс начал подозревать, что вирус Шоупа доставлял в клетки ген, ответственный за повышенную выработку аргиназы. Он удивился, что вирус способен переносить генетическую информацию столь эффективно, и задался вопросом: а смогла бы специально сконструированная версия вируса доставлять в клетки другие, полезные гены? Много лет спустя Роджерс вспоминал: “Было ясно, что в поисках болезни мы открыли средство лечения!”[20]
Ему не пришлось долго ждать случая, чтобы протестировать свою теорию на реальных пациентах. Спустя всего несколько лет у двух девочек из Германии было диагностировано наследственное расстройство под названием гипераргининемия. Как и у кроликов, инфицированных папилломавирусом Шоупа, у пациенток были аномальные уровни аргинина в крови – однако на этот раз не пониженные, а слишком высокие. Ген, ответственный за производство аргиназы (как подозревал Роджерс, именно этот ген переносился вирусом Шоупа), в организмах девочек либо отсутствовал, либо мутировал.
Симптомы гипераргининемии ужасны: в их числе постепенно усиливающиеся спазмы, эпилепсия и серьезная умственная отсталость. Однако был шанс, что вмешательство на ранней стадии, особенно в случае младшей пациентки, могло предотвратить наиболее тяжелые последствия заболевания. Роджерс и его немецкие коллеги ввели девочкам вирус Шоупа в терапевтических целях, сделав инъекцию больших доз очищенного вируса кроликов прямо в кровоток.
К сожалению, экспериментальная генная терапия Роджерса обернулась разочарованием – и не только для него, но и, что более печально, для его пациентов и их семьи. Инъекции не оказали почти никакого воздействия ни на одну из девочек, а Роджерса массово порицали за процедуру, которую многие его коллеги сочли безрассудной и непродуманной[21]. Дальнейшее исследование показало, что вопреки предположениям Роджерса в вирусе Шоупа даже не содержалось гена аргиназы[22], поэтому он не мог никак быть полезен для лечения гипераргининемии.